Stabilité et contrôlabilité
La période d’entretien de l’anesthésie est, par simplification, la période qui va de la fin de l’induction jusqu’au début des modifications programmant le réveil. La durée de l’entretien est plus ou moins longue, fonction de nombreux facteurs, dont le principal est la durée de l’acte chirurgical.
Pour un agent halogéné, l’entretien de l’anesthésie commence lorsqu’on décide d’arrêter l’ascension de la fraction expirée (Fe) de l’halogéné, débutant ainsi le pseudo-plateau de la courbe de Fe. L’évolution du rapport Fa/Fi (rapport fraction alvéolaire/fraction inspirée) est une autre expression du même phénomène : Fa/Fi doit se rapprocher de 1.
Pratiquement, l’entretien de l’anesthésie commence quand on réduit l’administration "généreuse" de l’agent halogéné, par fermeture du vernier de l’évaporateur (réduction de la Fd), ou par "fermeture du circuit" (réduction du débit de gaz frais : DGF).
L’anesthésie à bas débit de gaz frais est une méthode bien adaptée à la période d’entretien, permettant d’apporter au patient une quantité d’agent halogéné équivalente à celle que le patient capte et/ou qui sort du circuit par la soupape ou par les fuites. Le bas DGF est particulièrement adapté aux agents halogénés de solubilité basse. Le nouvel essor des circuits avec bas DGF résulte des progrès des analyseurs de gaz et vapeur anesthésiques, qui diminuent les deux risques de ces circuits : hypoxie et surdosage (1).
À la période d’entretien, le circuit à bas DGF est synonyme de réduction du coût de l’anesthésie.
En routine, l’entretien consiste pour l’anesthésiste à délivrer au patient les quantités de produits consommées, métabolisées ou évacuées : une relative économie s’établit ainsi entre le patient et l’appareil d’anesthésie (figure 1) :
1. Le bas débit de gaz frais (DGF) traverse l’évaporateur, entraînant de faibles quantités d’agent halogéné inhalées par le patient.
2. Une certaine stabilité de la fraction alvéolaire de l’agent halogéné s’installe, entre les apports (faibles) et la fixation périphérique par les tissus du patient (d’autant plus faible que l’agent halogéné est peu liposoluble). Cette stabilité de la fraction alvéolaire est volontiers appelée "pseudo-plateau" alvéolaire.
3. Un état d’équilibre s’établit alors entre la fraction alvéolaire (Fa) et la concentration dans le cerveau. Le niveau de cet équilibre est choisi, pour chaque agent, en fonction de sa concentration alvéolaire minimale (CAM ou MAC) (2).
4. Au niveau périphérique, une faible captation tissulaire de l’agent halogéné (faible liposolubilité, faibles coefficients : muscle/sang et graisse/sang) assure cette stabilité.
5. Ainsi le sang veineux retournant vers l’alvéole reste "chargé" en agent halogéné, le gradient alvéolo-capillaire est faible, l’extraction d’agent halogéné de l’alvéole vers le capillaire est limitée. Cela justifie un faible apport en halogéné, grâce à un bas DGF à la période d’entretien.
L’entretien est une période plus ou moins délicate pour l’anesthésiste en fonction du déroulement de l’acte opératoire : tout peut bien se passer, ou des événements intercurrents peuvent mettre en alerte (hémorragie, instabilité tensionnelle du malade, prolongation de la chirurgie...). Dans tous les cas, l’anesthésiste attendra de l’agent halogéné qu’il satisfasse les deux exigences suivantes :
Stabilité
• clinique : le patient ne manifeste aucun signe de réveil ;
• hémodynamique : fréquence cardiaque, pression artérielle moyenne (PAM) etc. sont stables;
• cinétique : le pseudo-plateau est horizontal.
Contrôlabilité
• clinique : variations de la profondeur de l’anesthésie ;
• hémodynamique : contrôle de la PAM par l’agent anesthésique ;
• cinétique : modifications rapides de la Fa de l’agent halogéné.
Les signes cliniques et hémodynamiques de l’anesthésie ne posent généralement pas de problème aux anesthésistes. Sont donc développés ici les aspects cinétiques moins bien connus, et moins publiés pour la période d’entretien. En pratique, c’est le monitorage de la fraction télé-expiratoire (Fe) qui permet de suivre la cinétique d’un agent halogéné (3), à la place de la Fa.
STABILITÉ DE L’ANESTHÉSIE À LA PÉRIODE D’ENTRETIEN
L’évolution de la fraction expirée (Fe) de l’agent halogéné (lue sur l’analyseur) est le témoin de la stabilité recherchée avec un bas débit de gaz frais (DGF).
1 - Au moment de la réduction du DGF classique "passage du circuit ouvert au circuit fermé", la Fe de l’halogéné baisse (équilibration de l’halogéné entre le patient et le circuit).
Cette baisse est d’autant plus forte que :
— l’induction est brève (moins d’imprégnation du patient),
— l’agent halogéné est plus soluble (captation périphérique dans les tissus du patient) (4),
— le DGF choisi est bas (faible apport de l’agent dans le circuit) (5).
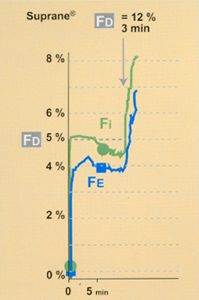
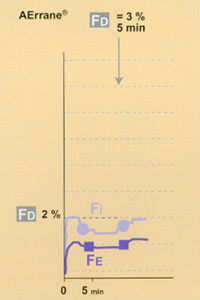
Avec un agent halogéné peu liposoluble (ex : Suprane®, DCI : desflurane) la chute de la Fe est limitée (6), la fraction délivrée (Fd) affichée peut rester au niveau de la concentration désirée (Fe) sans surconcentration (4), le DGF peut être très bas (figure 2, courbes du haut)*.
Avec un agent plus liposoluble (ex : AErrane®, DCI : isoflurane) la chute de la Fe est importante (6), la surconcentration est indispensable (4) (Fd>= 2 fois la Fe), d’autant plus que l’on voudra réduire le DGF de manière importante (figure 2, courbes du bas)*.
2 - Pendant la durée du pseudo-plateau, la Fe se modifie au fil du temps, et la courbe ne reste pas horizontale. Le phénomène est d’autant plus net que le DGF adopté est bas.
Avec un agent halogéné peu liposoluble (ex : Suprane®) la Fe tend à rejoindre la Fd (6), le plateau est légèrement ascensionnel (7). Une faible captation tissulaire par le patient explique cela (figure 2, courbes du haut)*.
Avec un agent halogéné plus liposoluble (ex : AErrane®) la Fe tend à s’abaisser, le plateau est légèrement décroissant (6) si l’on n’a pas conservé une Fd bien plus haute (surconcentration) que la Fe délivrée (figure 2, courbes du bas)*.
3 - Des facteurs liés au patient peuvent influencer le choix de l’agent halo-géné : chez l’obèse, le choix d’un halogéné peu liposoluble (ex : desflurane) permet d’obtenir une cinétique et une stabilité du pseudo-plateau identiques à celle de l’adulte "normal" même pour un très bas DGF (figure 3)*.
Lors d’une anesthésie de longue durée, l’imprégnation du patient par l’agent halogéné est d’autant plus forte que (5) :
— l’agent halogéné est liposoluble,
— les débits sanguins tissulaires locaux sont élevés,
— la durée est longue.
C’est au moment du réveil que s’exprime cliniquement l’imprégnation du patient par l’halogéné. Le délai de réveil est fortement dépendant du temps d’élimination du produit. La rapide élimination d’un agent halogéné peu liposoluble (ex : desflurane) entraîne un réveil précoce même après une longue anesthésie. Cela fera l’objet d’un article ultérieur à paraître dans Vocation Hôpital.
4 - Enfin certains facteurs, dont l’importance est moindre, peuvent aussi intervenir sur la cinétique de l’agent halogéné à la période d’entretien, et ne sont pas développés ici (1, 5) : volume du circuit, temps de saturation du circuit, dégradation de l’agent halogéné par l’absorbeur de CO2, pertes transcutanées...
5 - Au total, la recherche de la stabilité de l’anesthésie par inhalation, au moment de l’entretien avec un bas DGF donne l’avantage à un agent halogéné peu liposoluble (1, 6) :
— réduction précoce du DGF sans chute de la Fe (7),
— Fe proche en permanence de la Fd (4, 5),
— Fd affichée au niveau désiré de l’anesthésie.
CONTRÔLE DE L’ANESTHÉSIE À LA PÉRIODE D’ENTRETIEN
1 - La contrôlabilité de l’anesthésie ne fait pas l’objet d’une définition, ni même d’un consensus documenté.
Cliniquement, cette contrôlabilité vise la "profondeur" de l’anesthésie dont l’appréciation repose sur l’existence de mouvements du patient (indésirables), à défaut d’un monitorage fiable de la fonction cérébrale.
La surveillance de la fréquence cardiaque et de la pression artérielle du patient est souvent associée à la profondeur de l’anesthésie ; mais d’une part il s’agit plutôt du niveau d’analgésie, d’autre part la stimulation douloureuse n’est pas constante pendant l’acte chirurgical. Enfin, le remplissage vasculaire joue un rôle évident.
C’est donc la pharmacocinétique qui permet la meilleure approche de la contrôlabilité d’une anesthésie par inhalation :
"La différence entre la concentration d’anesthésique délivrée (Fd) par l’évaporateur, et la fraction alvéolaire (Fe en pratique quotidienne) définit le degré de contrôle du niveau de l’anesthésie (8). Un rapport Fd/Fe qui approche 1,0 indique un contrôle précis." En termes plus simples : plus la Fe lue sur l’analyseur s’écarte de la Fd sélectionnée sur l’évaporateur, plus le contrôle est mauvais. Une trop forte liposolubilité (ex : isoflurane) explique cela. La figure 4 illustre cette notion.
2 - La contrôlabilité de l’anesthésie par inhalation peut donc être assimilée, en pratique, à la rapidité avec laquelle peut être modifiée la Fe de l’agent halogéné.
• On peut choisir de remettre un haut débit de gaz frais ("circuit ouvert") puisqu’à la période d’entretien, le DGF est en général bas. On peut choisir de rester en bas DGF et d’augmenter la Fd de manière importante (surconcentration).
Avec un agent halogéné peu liposoluble (ex : desflurane) ces deux manœuvres peuvent se révéler équivalentes. La figure 5* illustre ce propos.
• Si l’on choisit de rester en bas DGF, le choix de l’agent halogéné est alors d’une grande importance.
Avec un agent halogéné peu liposoluble (ex : Suprane®) la "surconcentration" (Fd élevée) est suivie d’une ascension rapide et importante de la Fe : le contrôle est bon.
Avec un agent halogéné plutôt liposoluble la "surconcentration" n’entraîne pas de réponse rapide de la Fe, ce qui ne permet pas un bon contrôle. La figure 6* illustre ce propos.
Au total, la recherche de la contrôlabilité de l’anesthésie par inhalation, au moment de l’entretien de l’anesthésie avec un bas DGF, donne l’avantage à un agent halogéné peu liposoluble :
— réponse plus rapide de la Fe, proche de la Fd (10, 11),
— moins de surconcentration (10),
- réponse clinique plus rapide (10, 12, 13).
Bibliographie
1. FEISS P.
Uptake of anesthetics and clinical use of low flow anesthesia. Appl Cardiopulm Pathophysiol, 1995 ; 5 : 25-29
2. BUNODIERE M, LAPEYRE G.
Ce que vous vous êtes souvent demandé sur la MAC. Vocation Hôpital, 1996 ; 8 : 2-6
3. BUNODIERE M.
Anesthésie par inhalation, introduction du gaz : importance de la fraction alvéolaire (FA). Vocation Hôpital, 1997 ; 9 : 2-8
4. HARGASSER SH, MIELKE LL, ENTHOLZER EK et al. Experiences with the new inhalational agents in low-flow anesthesia and closed-circuit technique. Appl Cardiopulm Pathophysiol, 1995 ; 5: 47-57
5. EGER EI.
Uptake and distribution. In : MILLER RD. Anesthesia 4th ed. New-York : Churchill-Livingstone, 1994 : 101-123
6. LEE C, KWAN WF, TSAI SK, CHEN BJ, CHENG M.
A clinical assessment of desflurane anesthesia and comparison with isoflurane. Can J Anaesth, 1993 ; 40 : 487-494
7. LEE DJH, ROBINSON DL, SONI N.
Efficiency of a circle system for short surgical cases: comparison of desflurane with isoflurane. Br J Anaesth, 1996 ; 76 : 780-782
8. EGER EI.
New inhaled anesthetics. Anesthesiology, 1994 ; 80 : 906-922
9. EGER EI. II.
Desflurane (Suprane) A compendium and reference. Rutherford, Health press publishing group. 1993 ; 87
10. BENNETT JA, MAHADEVIAH A, STEWART J, LINGARAJU N, KEYKHAH M.
Desflurane controls the hemodynamic response to surgical stimulation more rapidly than isoflurane. J Clin Anesth, 1995 ; 7 : 288-291
11. THOMSON IR, BOWERING JB, HUDSON RJ, FRAIS MA, ROSENBLOOM M.
A comparison of desflurane and isoflurane in patients undergoing coronary artery surgery. Anesthesiology, 1991 ; 75 : 776-781
12. MESTARI M, PAUGAM C, BEAUSSIER M,
DERIAZ H, CHANDON M, SAUTET A, LAPEYRE G, LIENHART A.
Stabilité Hémodynamique lors de la Chirurgie du Rachis : Intérêt du desflurane.
Annales Françaises D’Anesthésie et de Réanimation 1998 ; (40) p 1033 - R 442
13. Avramov MN ; Griffin JD ; White PF
The effect of fresh gas flow and anesthetic technique
on the ability to control acute hemodynamic responseduring surgery.
Anesthesia and Analgesia 1998 ; 87 (3) : 666-670
Fig 1 Cinétique d'un agent halogéné à la période d'entretien, se reporter au texte.
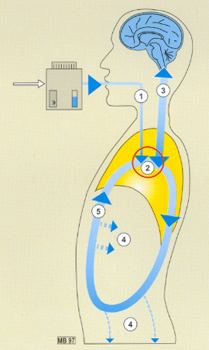
Fig 2 Evolution de la courbe de Fe lors d'une anesthésie à bas DGF (0,7 l/min), après quelques minutes de circuit ouvert : comparaison Suprane© versus AErrane©.
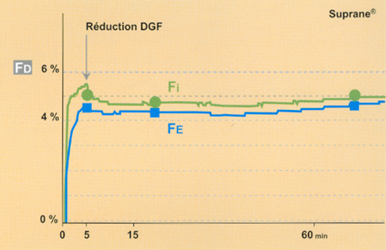
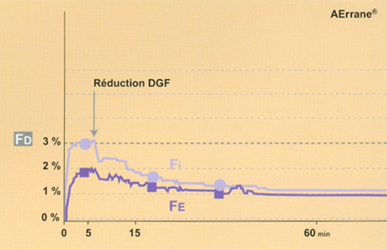
Fig 3 Evolution de la courbe de Fe lors d'une anesthésie à bas DGF (1 l/min), après quelques minutes de circuit ouvert, chez un sujet obèse (femme 89 kg pour 1,78 m) : exemple du desflurane.
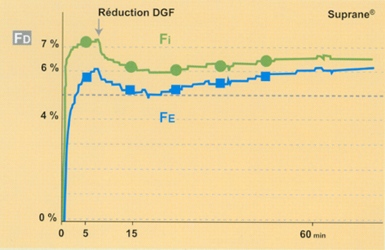
Fig 4 Evolution du rapport Fd/Fa pour un bas DGF de 1 l/min dans le circuit : comparaison desflurane versus isoflurane. D'après EGER EI, II (9).
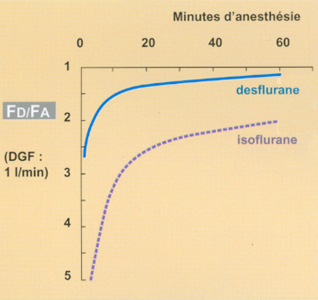
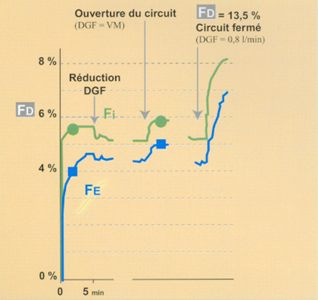
Fig 6 Contrôlabilité de la courbe Fe lors d'une anesthésie à bas DGF (0,8 l/min : comparaison desflurane versus isoflurane (Fd = 3 x Fe).